Đột quỵ là một nguyên nhân gây tử vong và tàn tật hàng đầu thế giới. Tỉ lệ này đặc biệt cao ở các nước phát triển. Vì vậy, các kế hoạch điều trị để ngăn tế bào thần kinh chết được đề ra. Tuy nhiên, liệu pháp tế bào gốc (SC) có thể thay thế cho phương pháp chặn đứng bệnh. Trong bài Đột quỵ và tế bào gốc: Phương pháp điều trị tổng quan, Medplus trình bày ngắn gọn về các phương pháp điều trị SC khác nhau. Đồng thời, chúng tôi thảo luận kết quả thử nghiệm.
Đột quỵ và tế bào gốc: Phương pháp điều trị tổng quan
1. Giới thiệu
1.1. Đặc trưng
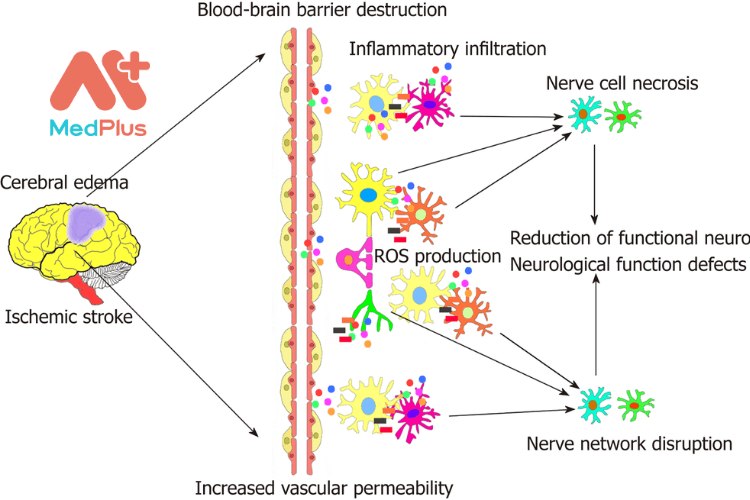
Đột quỵ có hai triệu chứng phổ biến xuất huyết và thiếu máu cục bộ. Dạng sau xuất hiện nhiều hơn, gần 80% [ 1, 2 ]. Các tế bào não nhạy cảm và các chấn thương như thiếu máu cục bộ khiến việc điều trị cho những bệnh nhân đột quỵ mắc bệnh nền gặp khó khăn. [ 3 ]
Sau giai đoạn cấp tính, một số thủ thuật điều trị y tế đã được áp dụng. Tuy nhiên, nhiều bệnh nhân rơi vào tình trạng xấu. [ 4 ] Vì vậy, thực tế đặt ra các chiến lược ngăn chặn tế bào thần kinh chết. Mặt khác, [ 5 ] quá trình đột quỵ cấp tính diễn ra nhanh. Nhiều loại tế bào bao gồm tế bào nội mô và thần kinh bị mất. Do đó, não cần cấy ghép để phục hồi.
1.2. Tóm lược
Tuy nhiên, liệu pháp tế bào gốc (SC) có thể can thiệp để điều chỉnh bệnh. [ 5 ]
Trong bài viết này, chúng tôi trình bày một đánh giá ngắn gọn về mối quan hệ giữa đột quỵ và tế bào gốc. Bạn hãy đón đọc để biết thêm chi tiết.
2. Mối liên hệ giữa “đột quỵ và tế bào gốc”
2.1. Cơ chế sửa chữa mô
Khái quát
Mối liên hệ giữa đột quỵ và tế bào gốc đã được thảo luận. Vì tế bào gốc hoạt động thiếu triệt để và cụ thể. [ 6, 7 ] Việc ghép chúng vào não vật chủ để thay thế mô bị tổn thương được đánh giá tốt. Tuy nhiên, nó vẫn còn nhiều hạn chế. Ngoài ra, người ta cũng xác nhận việc phân phối tế bào cấp tính có thể thu hẹp vùng tổn thương và ức chế quá trình apoptosis. Điều này cho thấy nó có vai trò quan trọng trong việc điều hòa miễn dịch và bảo vệ hệ thần kinh. Do tế bào gốc có thể ngăn nhiều phản ứng viêm và miễn dịch ở vật chủ được cấy ghép. Đồng thời chúng cũng sửa chữa mạch máu, thúc đẩy tăng sinh nội mô ở vùng quanh mạch máu. [ 8 – 12 ]
Cụ thể
Theo cơ chế được đề cập trong SC, hai chiến lược được trình bày làm giảm quá trình thoái hóa diễn ra. Một là cấy ghép các SC để cung cấp các tế bào thần kinh mới vào não bị nhiễm trùng bằng cách
- kích hoạt các tế bào gốc thần kinh nội tại (NSC),
- hoặc cung cấp các SC bên ngoài như tế bào gốc phôi (ESC),
- và tạo ra tế bào gốc đa năng (iPS) có nguồn gốc từ tế bào thần kinh.
Cách tiếp cận thứ hai là sử dụng SC bằng cách hỗ trợ điều hòa miễn dịch và bảo vệ tế bào thần kinh trong vùng được cấy ghép. [ 6 , 7 ]
2.2. Sự hình thành tế bào thần kinh nội sinh
Người ta đã báo cáo rằng hai vùng hạn chế của não động vật có vú trưởng thành bao gồm
- vùng dưới đồi (SGZ),
- và vùng dưới não thất (SVZ) của tâm thất bên là một nguồn NSC phong phú có liên quan đến quá trình hình thành tế bào thần kinh. [ 13, 14 ]
Tính năng
NSC của SGZ có thể tăng sinh và biệt hóa. Chúng chủ yếu biến thành các tế bào thần kinh trong tình trạng thiếu máu cục bộ. Và chúng có khả năng xuất hiện ở người. Việc sử dụng yếu tố kích thích tế bào bạch cầu hạt (G-CSF) là một ví dụ đáng chú ý. Nó được sử dụng thường xuyên trong các bệnh lý ác tính về máu để kích hoạt các SC nội sinh dùng cấy ghép. [ 15 ]
Kiểm chứng
Qua quan sát mối liên hệ giữa đột quỵ và tế bào gốc ở loài gặm nhấm, G-CSF đã được chứng minh là có lợi, [ 16, 17.] Bằng cách kích thích phát triển tế bào của SGZ và huy động SC đến não. [ 16 ] Điều này cho kết quả khả quan trên động vật. Nó đã mở ra cơ hội cho việc cấy ghép trong giai đoạn thử nghiệm lâm sàng I / II về tế bào gốc và đột quỵ [ 18 – 21 ]. Mặc dù, không chắc rằng G-CSF hoạt động như một chất bảo vệ tế bào thần kinh hoặc kích thích phục hồi chúng ở bệnh nhân sau cơn đột quỵ.
2.3. Sự hình thành tế bào thần kinh ngoại sinh
Cho đến nay, các nguồn sau đây đã được kiểm chứng để sửa chữa não
- ESC và iPSs phân tách từ tế bào thần kinh,
- NSC hoặc các SC khác có nguồn gốc từ các mô khác nhau, ví dụ: tủy xương (BM).
Tuy nhiên, mọi nghiên cứu vẫn đang được tiến hành. Công việc khoa học cần cho thấy tính khả dụng trong thực tế. Câu hỏi đặt ra cho vấn đề đột quỵ và tế bào gốc vẫn cần thời gian tìm câu trả lời cụ thể.
2.4. Tế bào gốc phôi và tế bào iPSs
Công bố
Năm 1998, ESCs lần đầu tiên được tìm thấy trong khối tế bào nằm bên trong phôi nang. [ 22 ] Chúng có thể được biệt hóa bằng nhiều phương pháp khác nhau thành phiên bản tiền thân của tế bào thần kinh. [ 23 ] Ở thí nghiệm trên động vật, tế bào ESCs có nguồn gốc từ tế bào thần kinh có thể
- tồn tại trong các tổn thương não do đột quỵ,
- và được biệt hóa thành các tế bào thần kinh trưởng thành. [ 15 ]
Hạn chế
Tuy nhiên, những lo ngại tiềm ẩn xuất hiện sau khi dùng ESC. Nó có khả năng phát triển không giới hạn trong môi trường nuôi cấy. Điều này có thể liên quan đến
- nguy cơ hình thành u ác,
- và lo ngại đạo đức về việc phá hủy trứng đã thụ tinh của con người.
IPS được tìm thấy vào năm 2007 [ 24 ]. Nó có thể cấp một hỗn hợp gồm bốn yếu tố phiên mã bao gồm
- c-myc,
- Sox 2,
- oct 4,
- và k1f4, còn được gọi là yếu tố yamanaka trên nguyên bào sợi da người.
Người ta đã xác nhận rằng các tế bào IPS có thể được biệt hóa thành nhiều loại tế bào thần kinh khác nhau.
Nỗ lực
Bất chấp vấn đề đạo đức, đặc tính hình thành u ác cao, các tế bào IPS vẫn được nghiên cứu. Một vấn đề quan trọng và ngày nay nhờ kỹ thuật Y học hiệu việc tái lập trình chúng đã được nâng cao. Chúng ít xâm lấn trong việc tạo ra các iPS. [ 25 ] Cơ hội này tạo niềm tin đặc biệt cho các khoa nghiên cứu đột quỵ và tế bào gốc. Tin chắc không lâu nữa, giới Y học tìm ra phương pháp chữa trị đáng tin cậy và hiệu quả.
2.5. NGHIÊN CỨU về đột quỵ và tế bào gốc GẦN ĐÂY
Nguồn gốc
NSC là một trong những phần phụ của SC có thể ghép cho người trưởng thành. Đặc biệt nó được tìm thấy trong não thai nhi và động vật có vú trưởng thành. Nó có khả năng biệt hóa thành ba loại tế bào chính của hệ thần kinh trung ương (CNS)
Đặc điểm
Không giống ESC và NSC của thai nhi, NSC của người lớn có thể được sử dụng lo vi phạm vấn đề đạo đức. [ 28 ] Tuy nhiên, có một số trở ngại lớn trong ứng dụng lâm sàng. Nguồn cung NSC là vấn đề quan trọng nhất và phải xác định được nguồn NSC thích hợp cho con người. NSCs tách khỏi não người lớn dưới dạng các tế bào thần kinh và tạo ra các tế bào thần kinh trong các điều kiện biệt hóa trong ống nghiệm. [ 29, 30] Người ta đã chỉ ra rằng việc cung cấp NSC qua đường tĩnh mạch hoặc trong nhu mô có thể cải thiện khả năng cải thiện tình trạng đột quỵ ở loài gặm nhấm. [ 31, 32 ]
2.6. Dòng tế bào
Loại 1
Một số dòng SC từ hệ thần kinh trung ương của loài gặm nhấm và người đã được giới thiệu như một nguồn cấy ghép khác. Ví dụ như dòng tế bào bất tử “NT2”, một dòng tế bào ung thư biểu mô tuyến ở người gắn với tế bào thần kinh. Nó có nguồn gốc từ khối u tế bào mầm tinh hoàn của người. [ 33 ]
Loại 2
Một dòng tế bào khác, “tế bào MHP 36” của NSCs của chó đã được chứng minh là làm giảm nhồi máu và cải thiện khả năng sinh tồn sau khi cấy ghép. [ 34 ] Gần đây, việc sản xuất các dòng tế bào bất tử của NSCs từ bào thai người đã được giới thiệu. HB1.F3 là một trong số chúng. Nó đã được chứng minh có khả năng
- biệt hóa thành tế bào thần kinh,
- và di chuyển khỏi địa điểm được tiêm đến các vị trí giải phẫu khác cơ thể chuột đột quỵ. [ 34 ]
2.7. Tế bào gốc khác
Có hai quần thể SC với các thế hệ riêng biệt trong BM trưởng thành
- tế bào gốc tạo máu (hSCs),
- và tế bào gốc trung mô (MSCs).
Tính năng
MSC có thể biệt hóa thành sụn, mỡ, xương và cơ. Một số nghiên cứu cho thấy chúng có khả năng biệt hóa thành các tế bào giống tế bào thần kinh in vitro [ 35 ] và in vivo [ 36 ]. Mặc dù có bằng chứng cho thấy sự biệt hóa này rất hiếm. Có một số ưu điểm hữu ích trong việc áp dụng MSCs trên lâm sàng bao gồm
- dễ dàng lấy được từ BM,
- tiềm năng cấy ghép tự thân,
- không cần ức chế miễn dịch,
- tránh các vấn đề đạo đức liên quan đến việc dùng các tế bào có nguồn gốc từ phôi và bào thai,
- ít bị biến đổi thành u ác tính và điều hòa cơ chế di truyền [ 8, 25 ]
Thực nghiệm
Trong các thí nghiệm động vật gặm nhấm bị đột quỵ, việc cấy ghép MSC thông qua các đường tiêm tĩnh mạch, nội động mạch và nội não đã cho thấy có tác dụng cải thiện chức năng não. [ 37 – 39 ]
Nó có tác dụng
- điều hòa miễn dịch mạnh mẽ trên hệ miễn dịch của vật chủ,
- và tiết ra một số yếu tố dinh dưỡng như tăng trưởng nội mô mạch máu (VEGF), nuôi dưỡng hệ thần kinh có nguồn gốc từ não.
Công bố
Kết quả cho thấy những tế bào này được xem là ứng cử viên tuyệt vời để điều trị bệnh thần kinh ở người lớn. [ 29 ]
Ngoài ra, việc sử dụng hSCs để cấy ghép BM cũng đã được nghiên cứu. Việc cấy ghép tế bào CD34 + một cách hệ thống hoặc trong não (bao gồm các quần thể tế bào gốc và tế bào gốc tạo máu và nội mô) có thể giảm kích thước ổ nhồi máu và phục hồi chức năng não động vật. [ 15 ] Đến đây, giới Y học đã xác thuyết vị trí cấy ghép và loại tế bào thích hợp trong việc cụ thể hóa vấn đề đột quỵ và tế bào gốc.
2.8. Liệu pháp tế bào ngoại sinh
Một điểm quan trọng khác trong phương pháp cấy ghép SC là con đường cấy ghép tế bào. Tuy nhiên, ta rất khó để tìm ra thời điểm cấy ghép tối ưu. Vì nhiều nghiên cứu đã sử dụng
- các mô đột quỵ,
- loại tế bào,
- phương pháp phân phối tế bào,
- và các phép đo kết quả riêng biệt để đánh giá hiệu quả.
Quy trình
Thời gian cấy ghép được tối ưu hóa dựa trên
- loại tế bào được sử dụng,
- và cơ chế hoạt động của chúng.
Việc sinh sản cấp tính nên được xem xét kĩ, nếu mục tiêu chính trong điều trị tập trung bảo vệ tế bào thần kinh. Nhưng vấn đề này sẽ khác nếu mục tiêu chính gắn với cơ chế sửa chữa. [ 40 ]
Thật vậy, việc dùng thuốc cũng tiết lộ thời điểm cấy ghép nội mạch. Và nó có thể tiến hành trong khoảng thời gian sớm từ 24 giờ đến một tháng sau khi khởi phát đột quỵ. Ngược lại, việc tiêm tế bào vào trong nhu mô sẽ được chọn khi phản ứng viêm ban đầu đã chấm dứt và tình trạng này có thể cho phép sự kết hợp tốt hơn. [ 25 , 29, 30 ]
Đáng lưu ý
Mặt khác, mọi việc quản lý y tế đều yêu cầu an toàn. Truyền tĩnh mạch toàn thân ít xâm lấn hơn việc tiêm vào não. Nhưng nó làm dấy lên lo ngại về sự hình thành microemboli. [ 26 ] Có vẻ như việc ức chế miễn dịch trong cấy ghép SC qua đường tĩnh mạch không mấy cải thiện hành vi vật chủ trong các nghiên cứu tiền lâm sàng.
Việc đưa vào động mạch cảnh được ưu tiên hơn tiêm tĩnh mạch. Nó tránh hàng rào miễn dich đầu tiên dẫn đến việc tế bào đi qua não tốt hơn. [ 15 ] Việc ghép nội mô gây xâm lấn nhiều. Hơn nữa vùng này có đặc điểm là môi trường viêm. Nó không hấp thu dinh dưỡng. Mảnh ghép tồn tại nhờ một tấm chắn phân phối. [ 26 ]
3. MỘT SỐ THỐNG KÊ
Tóm tắt
Hầu hết các thử nghiệm lâm sàng liên quan đến đột quỵ và tế bào gốc đều tập trung vào các phép đo chức năng vận động. Như thang điểm Rankin đã thay đổi chỉ số Barthel. Nó có thể bỏ qua tính khả dụng của các thang đo mức độ phục hồi khác. [ 29 , 30 ] Do có nhiều biểu hiện lâm sàng đột quỵ khác nhau, chúng tôi không thể mô tả một thang kết quả phục hồi bệnh cụ thể. Cramer và cộng sự cho biết các thử nghiệm lâm sàng “có kết quả theo phương thức”. [ 41] Tức là phép đo kết quả cụ thể phải hợp với từng bệnh nhân. Những bệnh nhân bị yếu chi trên cần xét nghiệm chức năng vận động, Fugl-Meyer. Những bệnh nhân mất khả năng ngôn ngữ cần được xem xét mức độ áp dụng.
Cho tương lai
Ngoài ra, sự phân bố tổn thương não và việc theo dõi khả năng sống sót, di chuyển và chức năng của các SC trong não vật chủ được đánh giá qua việc chụp cộng hưởng từ, hình ảnh phát quang sinh học và chụp cắt lớp phát xạ positron. [ 14 ] Rueger et al trình bày rằng việc huy động tế bào in vivo của NSC nội sinh trong SVZ sau đột quỵ có thể được đo bằng chụp cắt lớp phát xạ positron. [ 42 ]
4. CÁC THỬ NGHIỆM đột quỵ và tế bào gốc LÂM SÀNG
Các liệu pháp dựa trên tế bào gốc mở ra một cái nhìn đầy hứa hẹn trong điều trị đột quỵ. Năm 2007, các nhà nghiên cứu và thành viên của Viện Y tế Quốc gia đã được mời dự một cuộc họp. Họ được khuyến nghị tạo điều kiện thúc đẩy quá trình chuyển dịch các liệu pháp tế bào trên động vật đến các thử nghiệm lâm sàng có tên “Liệu pháp tế bào gốc như một mô hình mới nổi trong chống đột quỵ [STEPS ]. ” Sau đó, một cuộc họp thứ hai được tổ chức với tên gọi “STEPS 2” vào năm 2010. Tại cuộc họp này, các khuyến nghị mới đã được phân loại để tạo ra một hướng dẫn mới cho kế hoạch nghiên cứu trong tương lai dựa trên việc điều trị bằng SCs. [ 43 ]
4.1. Thứ nhất
Hicks và cộng sự [ 44 ] đã thảo luận về hiệu quả của liệu pháp tế bào trong 69 nghiên cứu phi lâm sàng khác nhau về đột quỵ. Liên quan đến sự khác biệt đáng kể giữa các mô hình động vật và người, một số câu hỏi bao gồm
- quy trình an toàn,
- liều lượng tế bào tối ưu,
- nguồn và đường phân phối,
- nhu cầu ức chế miễn dịch cần được làm rõ trước khi nghiên cứu liệu pháp SC ở người.
4.2. Tiến hành
Thử nghiệm lâm sàng trên 12 bệnh nhân bị nhồi máu hạch nền được báo cáo đầu tiên. Các tế bào thần kinh của người (tế bào NT2N) được cấy ghép theo phương pháp lập thể. Trong một cuộc theo dõi chụp cắt lớp vi mô phát xạ positron, ở 6 trong số 11 bệnh nhân sau 6 tháng, đã quan sát thấy sự gia tăng fluorodeoxyglucose tại vị trí cấy ghép. Các bệnh nhân khác cho thấy sự cải thiện trong Thang điểm cải thiện bệnh đột quỵ châu Âu (ESS) [ 45 ]. Thử nghiệm này được tiến hành lâm sàng ngẫu nhiên giai đoạn II để kiểm tra
- tính an toàn,
- tính khả thi,
- và hiệu quả của việc cấy ghép đối với đột quỵ hạch nền do thiếu máu cục bộ hoặc xuất huyết cho tám bệnh nhân.
4.3. Đánh giá
Bệnh nhân được tuyển chọn chia hai nhóm (7 người/ nhóm). Một nhóm dùng hai liều tiêm tế bào. Một nhóm không phẫu thuật (n= 4). Một cơn co giật duy nhất được quan sát ở một bệnh nhân vào ngày sau phẫu thuật. Và một bệnh nhân bị tụ máu dưới màng cứng 1 tháng sau khi nhồi máu. Kết quả chính ESS không có cải thiện nhưng một số thước đo kết quả thứ cấp như
- Thang đo tác động đột quỵ,
- Điểm bộ nhớ hàng ngày,
- Kiểm tra khả năng tiếp cận cử động cánh tay.
4.4. Thu hoạch
Tất cả đã phát triển đáng kể trong nhóm được cấy ghép suốt 6 tháng. Trong nghiên cứu này, tính khả thi của việc cấy ghép tế bào thần kinh đã được xác nhận. [ 46 ]
Trong một thử nghiệm nhỏ ở giai đoạn I, tế bào não thai heo đã được tiêm vào năm bệnh nhân bị nhồi máu hạch nền. Nhưng việc sử dụng thực phẩm và thuốc đã dừng thử nghiệm. Vì các tác dụng phụ đã xuất hiện ở hai bệnh nhân. Tình trạng thần kinh xấu đi 3 tuần sau khi can thiệp được quan sát ở một bệnh nhân. Và một bệnh nhân trải qua một cơn co giật 1 tuần sau khi cấy ghép. [ 47 ]
4.5. Thứ hai
Bang và cộng sự bắt đầu một nghiên cứu hiệu quả của việc cấy ghép MSC ở bệnh nhân đột quỵ. Năm bệnh nhân được tuyển chọn để cấy ghép tĩnh mạch MSCs tự thân bị đột quỵ do thiếu máu cục bộ vào 5 – 9 tuần sau khi khởi phát đột quỵ. Không có tác dụng phụ nào được ghi nhận ngay sau khi cấy ghép ở bệnh nhân. Tại thời điểm theo dõi 1 năm, chỉ số Barthel và điểm Rankin thay đổi cho thấy xu hướng này không có ý nghĩa điểm số tốt hơn ở những bệnh nhân được điều trị. Một quy trình tương đối an toàn và khả thi về mặt lâm sàng đã được xác nhận. [ 48 ] Tuy nhiên, nghiên cứu này do thiếu hành động theo dõi thích hợp nên có khả năng sai lệch.
4.6. Thứ ba
Lee và cộng sự cấy MSCs vào tĩnh mạch ở 52 bệnh nhân đột quỵ do thiếu máu cục bộ. Một thử nghiệm lâm sàng cho thấy nhãn cầu mở [ 49 ]. Và tiếp theo là một thử nghiệm lâm sàng thí điểm sử dụng tiêm tĩnh mạch MSCs đã được thực hiện trên 12 bệnh nhân đột quỵ do thiếu máu cục bộ 36-133 ngày sau đột quỵ. Họ kết luận rằng tiêm MSC tự thân vào tĩnh mạch có thể là một biện pháp an toàn và hiệu quả đối với đột quỵ do thiếu máu cục bộ. Hơn nữa, không có thử nghiệm lâm sàng nào được chứng minh về tính hiệu quả. [ 50 ]
4.7. Đánh giá chung
Ba thử nghiệm lâm sàng bổ sung hiện đang được tiến hành để điều tra vai trò của liệu pháp hSCs trong đột quỵ do thiếu máu cục bộ với các phương pháp sinh khác nhau. Các nghiên cứu này đã sử dụng tế bào CD34 + tự thân ở bệnh nhân đột quỵ cấp và mãn tính do thiếu máu cục bộ. Kết quả sẽ được công bố trong thời gian tới. [ 15 ]
4.8. Thứ tư
Một thử nghiệm lâm sàng khác được thực hiện bởi Rabinovich và cộng sự [ 51 ]. Tế bào bào thai người được cấy vào vùng dưới đồi của mười bệnh nhân bị đột quỵ. Họ không có kết luận chính xác về hiệu quả của nó do thiếu các phép đo kết quả.
Man et al năm 2006 [ 52 ] thiết kế phương pháp tiêm tế bào gốc máu cuống rốn người vào tĩnh mạch để đánh tình trạng bệnh nhân sau đột quỵ. Và không có tác dụng phụ nào được báo cáo. Sau 3 tháng theo dõi, Đánh giá Fugl-Meyer và Chỉ số Barthel tốt hơn đáng kể ở những bệnh nhân được cấy ghép. Và một quy trình khả thi, tương đối an toàn về mặt lâm sàng đã được kết luận. Hơn nữa trong nghiên cứu này, nhóm đối chứng không được thiết kế.
4.9. Thứ năm
Yang và cộng sự vào năm 2005 [ 53 ] đã thực hiện một thử nghiệm lâm sàng dựa trên việc tiêm NSC có nguồn gốc từ ESC cho 26 bệnh nhân. Sự cải thiện ở ESS và Chỉ số Bartel được báo cáo ở 23 bệnh nhân. Mặc dù thiếu nhóm chứng minh trong thiết kế này, không có tác dụng phụ nào được quan sát thấy ngoại trừ một cơn sốt thoáng qua ở bốn bệnh nhân. Gần đây, một thử nghiệm giai đoạn I đã được lên kế hoạch sử dụng dòng NSC, để tiêm lập thể cho bệnh nhân thiếu máu cục bộ (ReNeuron, Vương quốc Anh). [ 54 ]
4.10. Kết quả
Cuối cùng, do kích thước mẫu nhỏ và thiếu các đối chứng trong hầu hết các thử nghiệm lâm sàng này. Vì vậy rất khó để đưa ra kết luận chính xác. Chỉ trong một năm theo dõi Kondziolka et al và Bang et al không có báo cáo về sự hình thành u ác. Nhưng để bác bỏ giả thuyết tiềm ẩn khối u, cần phải theo dõi lâu dài. [ 28 ]
Có rất nhiều thách thức trong việc chuyển các nghiên cứu liệu pháp SC trên động vật sang thử nghiệm lâm sàng. Và khoa cấy ghép đề xuất gắn loại tế bào phù hợp vào toàn bộ hệ thần kinh để phục hồi chức năng hoàn toàn. Phát kiến này, gần đây, đang được quan tâm trong hầu hết các nghiên cứu về đột quỵ và tế bào gốc. [ 8 ]
4.11. Yêu cầu
Theo các tài liệu đã xuất bản trước đây, các nghiên cứu nâng cao hơn nên được thực hiện để xác nhận hiệu quả của việc cấy ghép SC điều trị đột quỵ. Chúng tôi không biết thủ thuật này có thể cải thiện chức năng não ở những bệnh nhân này hay không. Các thử nghiệm lớn và được thiết kế tốt nên chọn bệnh nhân đột quỵ để có quyết định áp dụng SC lâm sàng [ 61 ]. Cuối cùng, việc can thiệp này chưa được chứng minh ở người.
5. Kết luận
Và các câu hỏi chưa được giải đáp bao gồm
- loại tế bào phù hợp,
- số lượng tế bào cần dùng,
- thời gian điều trị tốt nhất,
- đường ghép tối ưu.
Tất cả phải được làm rõ trong tương lai. [ 15 ] Trong khi chờ đợi giới Y học công bố công trình nghiên cứu lớn: Đột quỵ và tế bào gốc – trị liệu tái tạo, ta cần bảo vệ sức khỏe bản thân. Bạn nên thăm khám tổng quát định kì 6 tháng một lần và duy trì thói quen sinh hoạt lành mạnh.
Tài liệu tham khảo
Sách
Xuất bản
Nội bộ
Viện nghiên cứu đột quỵ và tế bào gốc
Tiểu luận
Luận án
Công trình nghiên cứu đột quỵ và tế bào gốc
Cấp cơ sở
Cấp bang
Đại học Y
Khoa tế bào
Khoa dược lý
Số hóa
Một phần
Toàn văn
Hội thảo
Giáo trình
Thư viện công cộng
Nguồn liên quan
Tạp chí Y học
Bài viết liên quan đến chủ đề đột quỵ và tế bào gốc
- Lưu trữ máu cuống rốn: Quy trình đạt chuẩn quốc tế
- Thuật ngữ tế bào gốc MỖI NGÀY MỘT TRANG VIẾT KHOA HỌC
- Ngân hàng tế bào gốc: tiêu chuẩn đánh giá UY TÍN