Bạn cần chuẩn bị thông tin tình trạng bệnh và phương pháp chữa trị thông thường trước lúc chọn cơ sở y tế. Đặc biệt, nếu bạn quan tâm liệu pháp tế bào gốc bạn cần đọc bài FDA và liệu pháp tế bào gốc: cảnh báo và khuyến nghị.
FDA và liệu pháp tế bào gốc: cảnh báo và khuyến nghị
1. Giới thiệu
Các nhà nghiên cứu hy vọng tế bào gốc đạt hiệu quả trong việc
- điều trị bệnh tật,
- và chăm sóc y tế.
Nhưng các phương pháp điều trị bằng tế bào gốc chưa được công bố có thể không an toàn. Vì vậy bạn hãy tìm hiểu kĩ nếu bạn đang cần lựa chọn bất kỳ phương pháp điều trị nào.
Tế bào gốc được đánh giá cao trong việc chữa bệnh và lập phương pháp điều trị. Nhưng bạn đừng vội tin những lời đồn thổi. Một số cơ sở y tế vô đạo đức dùng các sản phẩm tế bào gốc chưa được phê duyệt và chứng minh. Vì vậy, bạn hãy cẩn thận trước các lời tư vấn nguy hiểm. Bạn cần xem xét bất kỳ phương pháp điều trị nào trước lúc lựa chọn. Bạn cũng nên tra vấn chủ đề FDA và liệu pháp tế bào gốc.
Sự thật
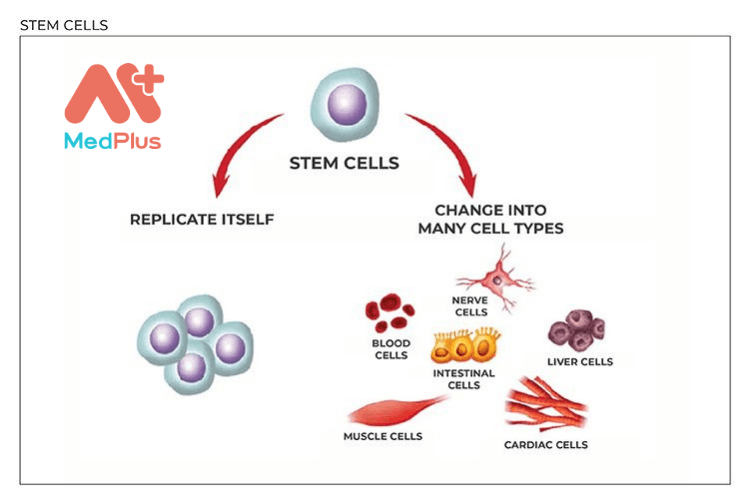
Liệu pháp tế bào gốc có thể mang lại tiềm năng lớn trong việc điều trị các bệnh tật khó chữa. Đôi khi chúng được gọi là “tế bào chủ” của cơ thể. Và nó có thể phát triển thành máu, não, xương và tất cả các cơ quan của cơ thể. Chúng có tiềm năng sửa chữa, phục hồi, thay thế và tái tạo tế bào. Vì vậy chúng đạt hiệu quả trong điều trị bệnh tật và chăm sóc y tế.
Nhưng Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ đã bày tỏ một mối lo ngại lớn. Một số bệnh nhân đang tìm cách chữa và cải thiện tình trạng bệnh tật có thể bị tổn hại sức khỏe nếu chọn liệu pháp tế bào gốc bất hợp pháp. Và FDA đang tăng cường giám sát, thực thi pháp luật để giúp mọi người khỏi các phòng khám tế bào gốc không trung thực, vô đạo đức. Đồng thời họ tiếp tục khuyến khích ngành y tế đổi mới hướng nghiên cứu để có thể khai thác tiềm năng của các sản phẩm tế bào gốc.
Lưu ý
Để an toàn, bạn hãy đảm bảo rằng bất kỳ liệu pháp tế bào gốc nào bạn đang cân nhắc đều
- Được FDA chấp thuận, hoặc;
- Được nghiên cứu theo các quy trình trong Đơn đăng ký thuốc mới (IND). Đây là một kế hoạch điều tra lâm sàng được FDA đề xuất và cho phép tiến hành.
- Và xem phần đóng khung bên dưới để hiểu rõ hơn.
2. FDA và liệu pháp tế bào gốc: Quy định hiện hành
FDA có thẩm quyền quản lý các sản phẩm tế bào gốc tại Hoa Kỳ.
Ngày nay, các bác sĩ thường sử dụng tế bào gốc lấy từ tủy xương hoặc máu trong quy trình cấy ghép để điều trị bệnh ung thư và rối loạn máu, hệ miễn dịch.
2.1. Công đoạn
Với một số ngoại lệ hạn chế, các sản phẩm tế bào gốc được nghiên cứu cũng phải trải qua quá trình xem xét kỹ lưỡng của FDA. Các nhà nghiên cứu cần xác định tính an toàn và hiệu quả của sản phẩm tế bào gốc trên người. Đây được gọi là thử nghiệm lâm sàng. FDA đã xem xét nhiều sản phẩm tế bào gốc sử dụng trong các nghiên cứu này.
Là một phần trong quá trình đánh giá của FDA, việc điều tra phải nêu rõ cách sản xuất từng sản phẩm. FDA dựa trên đó để hoạch định các bước phù hợp để giúp đảm bảo độ an toàn, tinh khiết và hiệu lực của sản phẩm. Họ cũng yêu cầu đủ dữ liệu nghiên cứu trên động vật để đánh giá mọi rủi ro tiềm ẩn liên quan đến việc sử dụng sản phẩm. Bạn có thể tìm hiểu thêm về các thử nghiệm lâm sàng trên trang web của FDA.
2.2. Vì vậy
Điều đó nói rằng, một số phòng khám có thể quảng cáo các thử nghiệm lâm sàng tế bào gốc mà không trình IND. Một số phòng khám cũng có thể quảng cáo sai sự thật. Việc xem xét và phê duyệt liệu pháp tế bào gốc của FDA đặc biệt quan trọng.
Các các thử nghiệm lâm sàng không được tiến hành theo IND. Điều này có nghĩa FDA không xem xét liệu pháp thử nghiệm chứng minh nó an toàn. Vì vậy, bạn hãy tránh xa những phương pháp điều trị này.
2.3. Giới thiệu sản phẩm tế bào gốc được FDA phê duyệt
Các sản phẩm tế bào gốc duy nhất được FDA chấp thuận để sử dụng ở Hoa Kỳ bao gồm
- các tế bào gốc tạo máu (tế bào tiền thân tạo máu), có nguồn gốc từ máu cuống rốn.
Các sản phẩm này được cho pháp sử dụng trên những bệnh nhân bị rối loạn chức năng sản xuất máu / hệ thống “tạo máu”. Các sản phẩm tế bào gốc được FDA chấp thuận này được liệt kê trên trang web của FDA.
Tủy xương cũng được sử dụng cho các phương pháp điều trị này. Nhưng thường nó không được FDA quy định cụ thể.
3. Mối quan tâm về độ an toàn của các liệu pháp tế bào gốc chưa được chứng minh
Tất cả các phương pháp điều trị y tế đều có lợi ích và rủi ro. Nhưng các liệu pháp tế bào gốc chưa được chứng minh đặc biệt không an toàn.
Ví dụ, những người tham dự hội thảo FDA năm 2016 đã thảo luận về một số trường hợp bị tác dụng phụ nghiêm trọng. Một bệnh nhân bị mù do được tiêm tế bào gốc vào mắt. Một bệnh nhân khác được tiêm tế bào gốc vào tủy sống. Và ông ta có khối u trong tủy sống.
Các mối quan tâm khác về độ an toàn của các liệu pháp tế bào gốc chưa được chứng minh bao gồm:
- Phản ứng của trang quản trị,
- Khả năng di chuyển của các tế bào từ các vị trí được sắp xếp khiến chúng trở thành các loại tế bào không phù hợp hoặc sản sinh tự phát,
- Các tế bào không hoạt động như mong đợi, và điều này dẫn đến việc hình thành các khối u.
Lưu ý: Ngay cả khi tế bào gốc là tế bào của chính bạn, vẫn có những rủi ro như đã lưu ý ở trên. Ngoài ra, nếu các tế bào được cấy ghép bị loại bỏ, chúng đã có thể làm ô nhiễm các tế bào khác.
4. Hành động của FDA và liệu pháp tế bào gốc không đạt chuẩn
Nếu các sản phẩm tế bào gốc
- được sử dụng theo những cách chưa được phê duyệt,
- hoặc nếu chúng được xử lý theo những cách để thao túng về sau.
tùy bản chất hành vi và mức độ xử lý có mức xử phạt riêng. FDA có thể thực hiện (và đã ban hành) nhiều chế tài hành chính và văn bản tư pháp. Chúng bao gồm cả việc thực thi hình sự, tùy thuộc vào các vi phạm liên quan.
Vào tháng 8 năm 2017, FDA đã gửi thông báo thực thi mạnh các quy định và giám sát các phòng khám tế bào gốc. Để rõ, bạn hãy xem tuyên bố của Ủy viên FDA Scott Gottlieb, MD, trên trang web của FDA.
Và vào tháng 3 năm 2017, để làm rõ những lợi ích và rủi ro của liệu pháp tế bào gốc, FDA đã xuất bản một bài báo bày tỏ quan điểm trên Tạp chí Y học New England. Họ tuyên bố miễn trừ trách nhiệm liên kết các cơ sở bên ngoài.
FDA sẽ tiếp tục hỗ trợ phát triển và cấp phép cho các liệu pháp tế bào gốc mới. Nếu chúng có bằng chứng khoa học chứng minh tính an toàn và hiệu quả của sản phẩm.
5. Lời khuyên cho những người quan tâm liệu pháp tế bào gốcDẫu biết, FDA đóng một vai trò trong việc giám sát việc điều trị bằng tế bào gốc. Bạn có thể được tư vấn:
Điều đó không đúng. Các sản phẩm tế bào gốc có khả năng điều trị nhiều bệnh tật và chăm sóc y tế. Nhưng hầu hết các sản phẩm này, FDA vẫn chưa biết liệu sản phẩm mang lại lợi ích gì cụ thể? Hoặc liệu sản phẩm có an toàn để sử dụng hay không? 5.1. Nếu bạn đang cần điều trị ở Hoa KỳBạn hỏi xem, FDA đã xem xét phương pháp điều trị đó chưa. Bạn nên yêu cầu nhà cung cấp dịch vụ chăm sóc sức khỏe của bạn xác nhận thông tin này. Bạn cũng có thể yêu cầu nhân viên điều tra lâm sàng cung cấp cho bạn
Bạn hãy hỏi thông tin này trước khi điều trị ngay cả khi tế bào gốc là của riêng bạn. Bạn nên đặt câu hỏi nếu bạn không hiểu. Để tham gia một thử nghiệm lâm sàng cho đơn IND, bạn phải ký vào một mẫu đơn đồng ý, có giải thích quy trình thử nghiệm. Mẫu đơn đồng ý cũng xác định Ban Đánh giá Quy định (IRB) đảm bảo việc bảo vệ các quyền và phúc lợi của các đối tượng con người. Đảm bảo rằng, bạn hiểu toàn bộ quy trình và những rủi ro đã biết trước khi ký. Bạn cũng có thể yêu cầu nhà tài trợ nghiên cứu cung cấp
5.2. Nếu bạn đang cần điều trị ở một quốc gia khác
|
Xem thêm bài viết
- Các loại tế bào gốc: phân biệt để nghiên cứu cơ chế và ứng dụng
- Tái tạo tinh trùng: Tế bào gốc trị bệnh vô sinh ở nam giới?
- Tái tạo thủy tinh thể: dùng tế bào gốc thay thế mô hình phẫu thuật
Nguồn: FDA